作成: 2007/12/11 織内 昇
データ番号 :030293
悪性褐色細胞腫の131I-MIBGによる放射線内照射療法
目的 :131I-MIBGによるアイソトープ内照射療法の理解と普及
放射線の種別 :ベータ線
放射線源 :131I
線量(率) :投与量3700MBq
利用施設名 :群馬大学医学部附属病院、金沢大学、北海道大学
照射条件 :内照射、内用療法
応用分野 :医療
概要 :
悪性褐色細胞腫は副腎髄質や交感神経節から発生するまれな悪性腫瘍で、放射性ヨウ素を標識したノルエピネフリンの類似体であるmeta-iodobenzylguanidine(MIBG)が集積する。手術不可能あるいは転移巣のある悪性褐色細胞腫の治療として、131I-MIBGによる内照射療法が行われる。この治療法は、薬品がわが国では承認されておらず罹患率が少ないこともあり、十分には認知されていない。本稿では131I-MIBGによる内照射療法について概説する。
詳細説明 :
1.はじめに
悪性褐色細胞腫は副腎髄質や交感神経節から発生するまれな腫瘍である褐色細胞腫のうちで悪性のものである。副腎髄質や交感神経節は交感神経の伝達物質であるエピネフリンやノルエピネフリンなどのカテコラミンを産生または貯蔵して神経伝達を行い、自律神経をコントロールする神経内分泌器官である。副腎は腎臓の上極に位置し、交感神経節は脊椎に沿って存在する。褐色細胞腫は後述するようなカテコラミンによる特徴的な症状が出現するため、医師の間ではよく知られた疾患であるが、発症率は人口100万人に対して年間に数人と少ない(参考資料1)。遺伝子に変異のある症例が比較的多く、それらは悪性のことが多いことがわかってきた(参考資料2、参考資料3)。悪性褐色細胞腫は約20%程度と考えられている。
褐色細胞腫は放射性ヨウ素を標識したノルエピネフリンの類似体であるmeta-iodobenzylguanidine(123I-MIBG、131I-MIBG)が集積するため、シンチグラフィにより全身の評価が可能である(参考資料4)。原発巣だけの場合には画像診断で悪性であることを診断するのは困難であるが、転移巣の存在により悪性と診断されることが多い。
悪性褐色細胞腫の治療として、131I-MIBGによるアイソトープ内照射療法が行われる(参考資料5)。原発巣は外科的治療が原則で、手術不能例や多発性転移ならびに術後再発例が内照射療法の対象となる。治療用の131I-MIBGは、わが国では承認されておらず、患者が個人輸入して使用しているのが現状である。罹患率が少ないこともあり、131I-MIBG治療は臨床の場で十分には認知されていない。したがって適正な診療を行うことが困難であるため、診療の指針となるガイドラインが作成されたところである。
2.MIBG治療の適応
1)適応疾患
この治療の適応は放射性ヨウ素標識MIBG(123I-MIBG、131I-MIBG)が集積する悪性の神経内分泌腫瘍で、外科的切除が不可能な場合である(表1)。
表1 131I-MIBGによる内照射療法の適応疾患
|
131Iまたは123I標識MIBGが集積する腫瘍
|
|
・手術不可能ないしは悪性の
|
|
褐色細胞腫瘍、傍神経節細胞腫、カルチノイド、
|
|
神経芽細胞腫瘍(3期および4期)
|
|
・手術不可能な甲状腺髄様癌
|
発生学的に神経堤と呼ばれる組織を発生母地とする末梢の交感神経組織から発生する腫瘍が適応である。適応の評価には、シンチグラフィを行い病巣へのMIBG集積を確認することが最も重要である。副腎髄質から発生する悪性褐色細胞腫、脊椎に存在する神経節を起源とするパラガングリオーマの他に、甲状腺髄様癌なども対象となる。外科治療が不適応な局所進行例や多発性の遠隔転移などが適応となる。良性の褐色細胞腫は、外科的に切除することで治癒可能であるが、数年の経過で転移が発見される例があり、そのような経過で臨床的に悪性と診断されることが少なくない。転移臓器は骨、肺、肝、およびリンパ節などである(図1)。
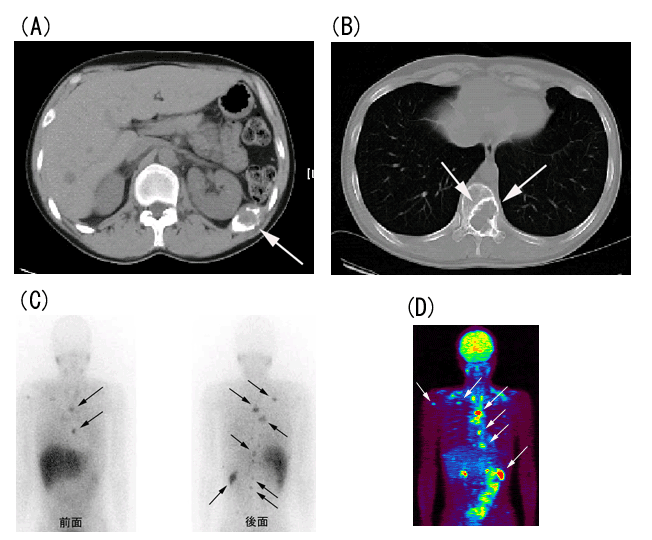
図1 31歳 女性 悪性褐色細胞腫
3年前に左副腎腫瘍の摘出を受け褐色細胞腫と診断された。治療後、経過観察のCTで骨転移が発見された。化学療法が行われたが、効果が不十分のため131I-MIBGによる放射線内照射療法を目的に紹介された。治療前評価として画像検査を行った。
(A)胸部CT:右肋骨に溶骨性の骨転移が認められる(矢印)。
(B)腹部CT:腰椎に溶骨性の骨転移が認められる(矢印)。
(C)123I-MIBGシンチグラフィ:胸椎、腰椎、右肩甲骨および左肋骨に123I-MIBGの異常な集積が認められる(矢印)。
(D)18F-FDG PET:右上腕骨、胸椎、右肋骨などに18F-FDGの異常な集積亢進が認められる(矢印)。
進行は緩徐なことが多いが、発見された時点で転移巣は多発性のことが多い。腫瘍が交感神経の伝達物質であるアドレナリンやノルアドレナリンなどのカテコラミンを分泌する場合には、高血圧、頭痛、発汗などの症状を発症して診断に結びつく。症状のない場合には診断が遅れ進行してから発見されることになりやすい。前述したような特徴的な症状を除くと、臨床的には疼痛や神経の圧迫などが問題となることが多い。悪性褐色細胞腫は、放射線に対する感受性が低いため、顕著な治療効果は望めない。悪性褐色細胞腫では、カテコラミンのなかでノルアドレナリンが高値のことが多く、それによる症状や前述の疼痛など、症状の緩和が治療の主目的である。
2)悪性褐色細胞腫の治療
悪性褐色細胞腫の治療は、131I-MIBGのほかに局所療法として可及的な摘出、放射線外照射、動脈塞栓術やラジオ波焼灼術などがあり、全身療法としては抗癌剤による化学療法やα-methyl-p-tyrosineがある。切除可能な場合には、外科治療が最も確実な治療法である。肝転移に対して動脈塞栓術が行われることがある。カテコラミンの分泌が盛んな腫瘍の場合には、治療で壊れた細胞から遊離したカテコラミンによる症状が出現する。ラジオ波焼灼術は、肝転移のほか、肺や骨の転移に対して施行されることがある。褐色細胞腫の骨転移は溶骨性の場合が多く、荷重のかかる脊椎や大腿骨の転移の場合には、骨折の危険があるため、そのような場合にはラジオ波焼灼術や骨セメントの注入による骨折予防が患者のQOLを維持する上でも重要な治療法となる。悪性褐色細胞腫の腫瘍細胞は、前述のように放射線治療に対する効果は少ない。疼痛緩和や神経圧迫の除去には放射線の外照射が効果的であり、緊急で施行されることもある。化学療法は主としてcyclophosphamide、vincristine、decarbazineの3剤による、いわゆるCVD療法が行われる。しかしその効果は十分とはいえない(参考資料5)。薬物療法のうち、α-methyl-p-tyrosineは未承認薬のため、個人輸入で使用しているのが現状である。
3)131I-MIBGによる悪性褐色細胞腫の内照射療法
131I-MIBGは、ノルエピネフリンの同族体であるMIBGにヨウ素の放射性同位体である131Iを結合した化合物で、前述のように褐色細胞腫の診断に用いられている。131Iは、物理学的半減期が8日で崩壊に伴いγ線のほかにβ線を放出する。したがって131I-MIBGが取り込まれた細胞内から放出されるβ線は、周囲の細胞も含めてDNAを傷害する。
131I-MIBGによる内照射療法は、妊婦や腎機能障害、造血機能障害には禁忌である。またアイソトープ治療病室に入院する必要性があるため、重症患者や副作用が重篤となることが予想される場合には全身管理や緊急時の対処が困難となるため、治療前に状態を把握し副作用を予測するとともに、適応とはならない症例を除外する必要がある。
適応の可能性がある場合には、まず検査目的に入院し、診察や検査を行って医学的な適応を判定すると同時に、治療の概要を面会が制限されることや、通常の入院費用とは別に131I-MIBGの薬品代と運送費、入関手続のため約35万円を輸入業者に支払うことなども含めて説明し、インフォームド・コンセントを行う。
4)131I-MIBGによる内照射療法の実施
ⅰ)前処置と131I-MIBGの投与
前処置として、131I-MIBGから遊離する131Iの甲状腺への集積を阻害して甲状腺機能低下症を予防するために、ヨウ化カリウムやルゴールなどを131I-MIBG投与の約3日前から内服させる。131I-MIBGの投与は、原則として中心静脈を確保した後、血圧や心電図をモニターし、カメラで全身状態を観察しながら、131I-MIBGを診断に用いる量の約100倍(3.7~7.4GBq)を30分程度かけて点滴静注する。
ⅱ)副作用
治療後数日に、治療によって傷害された細胞から放出されたカテコラミンによる作用で高血圧などの症状が引き起こされる場合がある。そのほか投与後の副作用には、悪心・嘔吐などの放射線宿酔や骨髄抑制などがある。
骨髄抑制は投与後4週~6週に見られることがあるが、頻度は多くなく程度も軽いことが多い。腎機能障害や造血機能障害は治療の適応外であるが、腫瘍の骨髄浸潤が高度の場合や前治療として多数回の化学療法が行われていた場合、および腎機能が治療後に悪化した場合などには骨髄抑制を生じうる。
晩期の副作用としては、甲状腺機能低下症や唾液腺機能の低下などが見られる。
5)131I-MIBG内照射療法の効果
悪性褐色細胞腫は放射線に対する感受性が高くないため、著明な抗腫瘍効果は得られない。これまでに諸外国を含む多数の論文に報告された治療成績では、奏功率は30%~40%である(参考資料5)。そのような成績をふまえて、現今の治療方針は、腫瘍の縮小は望めなくても症状の緩和やデータの改善を目標とするのが一般的になっている。
治療後には、カテコラミン分泌による症状や疼痛および高血圧などの臨床所見の変化を観察する。実際に症状の緩和やデータの改善は過半数に見られ、進行を抑えて日常生活を送ることができることが多い。123I-MIBGまたは131I-MIBGによるシンチグラフィも効果判定や増悪の評価に役立つ。最近では18F-FDG PETも治療効果判定に役立つと言われている(参考資料6、参考資料7)。
6)放射線安全管理に関する事項と内照射療法後の患者の解放
放射線内照射療法は、放射性医薬品の安全管理や実施施設の基準など、医療法の規制を受ける。以前は放射線障害防止法の規制も受けていたが、現在では保険適応のある131Iによるバセドウ病や甲状腺癌の内照射療法と同様に、医療法に準拠して施行することができる。131I-MIBGによる治療は保険適応外であるが、診療用放射性同位元素に準じて取り扱わなければならない。法規制が簡素化され、131I-MIBG内照射療法の適正使用ガイドラインが作成されたため、施行しやすい環境となった。
患者に直接関わるのは、退出基準を満たすまで治療病室に入院する必要のある点である。退出基準は患者から1mの距離で測定した放射線量が30μSv/hr以下であり、131I-MIBGの投与後5日から1週間でこの基準を満たすことが多く、その後は一般の病床に移ることができ、退院が可能となる。全身のシンチグラムを撮像して131I-MIBGが病巣に集積していることを確認することもできる。
7)被ばく低減のための患者への説明
退出基準を満たしてからも患者の体内にはある程度の放射能が残っているため、排泄物や体液に放射能が含まれる。したがって、退院する際には公共や家族の被ばく低減を目的に、治療直後の一定期間は、放射線に感受性の高い幼児や妊婦との密接な接触を避け、数か月程度は妊娠や授乳を避けることなどを指導する。
最近では空港などでテロ防止を目的とした放射線検知器が作動したり、ショッピングセンターなどで火災報知器の一種である炎感知器が誤作動したりしたとの事例が報告されている。場合によってはこれらの事項を患者に知らせ、放射性核種で治療を行ったことを記した証明書を携帯させる必要がある。
コメント :
治療用の131I-MIBGは、わが国では承認されておらず、患者が個人輸入して使用しているのが現状である。罹患率が少ないこともあり、131I-MIBG治療は臨床の場で十分には認知されていない。したがって適正な診療を行うことが困難であるため、診療の指針となるガイドラインが作成されたところである。
参考資料1 Reference 1:
Adrenal pheochromocytoma remains a frequently overlooked diagnosis.
Lo CY, Lam KY, Wat MS, Lam KS.
Departments of Surgery, University of Hong Kong Medical Centre, Queen Mary Hospital, Hong Kong, China.
Am J Surg 179: 212-215, 2000.
参考資料2 Reference 2:
Germ-line mutations in nonsyndromic pheochromocytoma.
Neumann HP, Bausch B, McWhinney SR, Bender BU, Gimm O, Franke G, et al.
Department of Nephrology and Hypertension, Albert Ludwigs University, Freiburg, Germany. neumann@mm41.ukl.uni-freiburg.de
N Engl J Med 346: 1459-66, 2002.
参考資料3 Reference 3:
The management of benign and malignant pheochromocytoma and abdominal paraganglioma.
Edstrom Elder E, Hjelm Skog AL, Hoog A, Hamberger B.
Department of Surgery, Karolinska Hospital, SE-171 76, Stockholm, Sweden. Elisabeth.Edstrom-Elder@ks.se
Eur J Surg Oncol 29: 278-283, 2003.
参考資料4 Reference 4:
Pheochromocytoma and the normal adrenal medulla: improved visualization with I-123 MIBG scintigraphy.
Lynn MD, et al.
University of Michigan, Ann Arbor, Michigan
Radiology. 155: 789-792. 1985
参考資料5 Reference 5:
Clinical review: Current treatment of malignant pheochromocytoma.
Scholz T, et al.
Institute of Parasitology, Biology Centre of the Czech Academy of Sciences, Branisovska 31, 370 05 Ceske Budejovice, Czech Republic
J Clin Endocrinol Metab 92: 1217-1225, 2007.
参考資料6 Reference 6:
Pheochromocytomas: imaging with 2-[fluorine-18] fluoro-2-deoxy-D-glucose PET.
Shulkin BL, et al.
Department of Internal Medicine, University of Michigan Medical Center, Ann Arbor 48109, USA. bshulkin@umich.edu
Radiology 212: 35-41, 1999.
参考資料7 Reference 7:
Monitoring the efficacy of iodine-131-MIBG therapy using fluorine-18-FDG-PET.
Menzel C, et al.
Department of Nuclear Medicine, Hospital of the J. W. Goethe University, Frankfurt, Germany. christian.menzel@em.uni-frankfurt.de
Acta Med Austriaca 30: 37-40, 2003.
キーワード:悪性褐色細胞腫、傍神経節細胞腫、カルチノイド、神経芽細胞腫、甲状腺髄様癌、131I-MIBG、123I-MIBG、放射線内照射療法
malignant pheochromocytoma, paraganglioma, carcinoid, neurobrastoma, medullary thyroid carcinoma, 131I-meta-iodobenzylguanidine, 123I-meta-iodobenzylguanidine, internal radiotherapy
分類コード:030302
